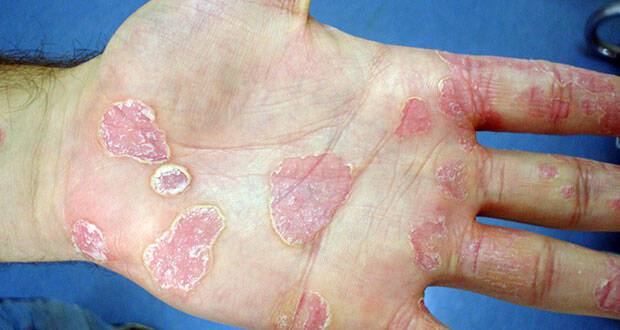
Δεδομένα από την καθημερινή κλινική εμπειρία με την απρεμιλάστη, μια από του στόματος χορηγούμενη θεραπεία για την ψωρίαση και την ψωριασική αρθρίτιδα, καταδεικνύουν βελτίωση στην ποιότητα ζωής. Πρόκειται για αποτελέσματα από γερμανική μελέτη, τα οποία ανακοινώθηκαν πρόσφατα στο Συνέδριο της Αμερικανικής Ακαδημίας Δερματολογίας και αποτελούν τα πρώτα δεδομένα καθημερινής κλινικής εμπειρίας που παρουσιάζονται για την απρεμιλάστη.
Το προφίλ ασφάλειας στο πλαίσιο της καθημερινής κλινικής εμπειρίας είναι αντίστοιχο με αυτό που παρατηρήθηκε στις κλινικές μελέτες. Τα πρώτα δεδομένα από την καθημερινή κλινική εμπειρία με την απρεμιλάστη σε ασθενείς με ψωρίαση κατά πλάκας παρουσιάστηκαν στο 75ο Ετήσιο Συνέδριο της Αμερικανικής Ακαδημίας Δερματολογίας (AAD 2017) στο Ορλάντο της Φλόριντα.
Η μελέτη LAPIS-PSO (μακροχρόνια τεκμηρίωση της χρήσης της απρεμιλάστης σε ασθενείς με ψωρίαση κατά πλάκας υπό συνθήκες καθημερινής κλινικής εμπειρίας) είναι μία πολυκεντρική, προοπτική, μη παρεμβατική μελέτη με τη συμμετοχή έως και 500 ασθενών, η οποία διεξάγεται σε περίπου 100 ερευνητικά κέντρα στη Γερμανία.
1 Η μελέτη αξιολογεί τη μακροχρόνια ποιότητα ζωής των ασθενών που λαμβάνουν θεραπεία με απρεμιλάστη στην καθημερινή κλινική πρακτική για ένα διάστημα που καλύπτει 5 επισκέψεις ή περίπου 13 μήνες. Πρόκειται για ασθενείς που είχαν προηγουμένως λάβει συμβατική συστηματική θεραπεία.
Τα δεδομένα που παρουσιάστηκαν στο Συνέδριο AAD 2017 προέρχονται από την ενδιάμεση ανάλυση της μελέτης, η οποία αξιολογεί 111 ασθενείς από 39 ερευνητικά κέντρα, με την ανάλυση ασφάλειας να βασίζεται σε δεδομένα από τους 108 ασθενείς που ολοκλήρωσαν τη δεύτερη επίσκεψη και έλαβαν περίπου 4 μήνες θεραπείας με 30 mg απρεμιλάστης δύο φορές την ημέρα.
Τα ενδιάμεσα αυτά δεδομένα από τη μελέτη LAPIS-PSO καταδεικνύουν ότι η απρεμιλάστη βελτίωσε την ποιότητα ζωής στο 64% των ασθενών, με μία μέση βελτίωση στη βαθμολογία του Δερματολογικού Δείκτη Ποιότητας Ζωής (DLQI) κατά περίπου 8 μονάδες σε περίπου 4 μήνες θεραπείας (2 επισκέψεις). Αυτό ήταν το κύριο καταληκτικό σημείο της μελέτης. Η γρήγορη έναρξη δράσης της απρεμιλάστης παρατηρήθηκε μέσω μίας μέσης μείωσης της βαθμολογίας του DLQI κατά περίπου 6 μονάδες και ενός ποσοστού ανταπόκρισης 65% ήδη από τον πρώτο μήνα μετά την έναρξη της θεραπείας. Η μέση βελτίωση του DLQI αυξήθηκε περαιτέρω στο διάστημα από την πρώτη έως τη δεύτερη επίσκεψη.
Παρατηρήθηκαν, επίσης, η αποτελεσματικότητα ως προς την προσβολή του τριχωτού της κεφαλής, την ψωρίαση ονύχων, την ψωρίαση παλαμών-πελμάτων, τον πόνο και τον κνησμό, καθώς και η ανεκτικότητα, η οποία ήταν το δευτερεύον καταληκτικό σημείο της μελέτης. Πριν από την έναρξη της θεραπείας με απρεμιλάστη, το 64% των ασθενών είχε βαθμολογία ≥3 στη Σφαιρική Αξιολόγηση του Τριχωτού της Κεφαλής από τον Ιατρό (ScPGA), η οποία ορίζεται ως μέτρια ή σοβαρή. Ωστόσο, στη δεύτερη επίσκεψη επιτεύχθηκε βαθμολογία 0 (καθαρό) ή 1 (σχεδόν καθαρό) στην ScPGA από το 51% των ατόμων με ψωρίαση τριχωτού κεφαλής (n=57).
Τα δεδομένα κατέδειξαν επίσης ότι το 23,3% των ασθενών (n=30) επέδειξε βελτίωση της ψωρίασης ονύχων μετά την πρώτη επίσκεψη. Το ποσοστό αυτό αυξήθηκε στο 66,7% μετά τη δεύτερη επίσκεψη. Μία σχετική βελτίωση στις βαθμολογίες του Δείκτη Βαρύτητας Ψωρίασης Ονύχων (NAPSI) σε συγκεκριμένα νύχια κατά τη δεύτερη επίσκεψη ήταν της τάξης του 54% (απόλυτη μεταβολή μέσης τιμής [SD]: −2,4 [1,85] από 4,2 [2,25] κατά την έναρξη της μελέτης). Σε ασθενείς με εκδήλωση ήπιας έως βαριάς μορφής παλαμοπελματιαίας ψωρίασης, το 80%, δηλαδή 8 στους 10 ασθενείς ήταν ελεύθεροι ή σχεδόν ελεύθεροι από συμπτώματα μετά τη δεύτερη επίσκεψη, όπως αξιολογήθηκε με τη χρήση του δείκτη Σφαιρικής Αξιολόγησης της Παλαμοπελματιαίας Ψωρίασης από τον Ιατρό (PPPGA).
Ο πόνος και ο κνησμός που σχετίζονται με τα δερματικά συμπτώματα της ψωρίασης έχουν σημαντική επίδραση στην ποιότητα ζωής των ασθενών., Όπως μετρήθηκε με τη χρήση μίας Οπτικής Αναλογικής Κλίμακας (VAS, 0–100 mm), ο κνησμός στη μελέτη LAPIS-PSO ήταν μειωμένος κατά 23,5 mm κατά μέσο όρο στην πρώτη επίσκεψη και κατά 27,5 mm στη δεύτερη επίσκεψη. Σε σύγκριση με την τιμή κατά την έναρξη της μελέτης (57,8 mm), η τιμή αυτή αντιστοιχεί σε μία μείωση κατά σχεδόν 50%. Ο πόνος παρουσίασε επίσης μείωση σχεδόν κατά το ήμισυ – με μία μέση τιμή 38,6 mm κατά την έναρξη της μελέτης, η οποία ήταν μειωμένη κατά 11,9 mm στην πρώτη επίσκεψη και κατά 20,7 mm στη δεύτερη επίσκεψη.
Η ενδιάμεση ανάλυση ασφάλειας συνάδει με το γνωστό προφίλ ασφάλειας της απρεμιλάστης. Η συνολική επίπτωση ανεπιθύμητων ενεργειών σε αυτό το χρονικό σημείο της ενδιάμεσης ανάλυσης ήταν χαμηλότερη από εκείνη στις κλινικές μελέτες. Η πιο συχνή ανεπιθύμητη ενέργεια ήταν η διάρροια, η οποία εμφανίστηκε στο 8,3% του πληθυσμού ασφάλειας της μελέτης (n=108).1 Άλλες ανεπιθύμητες ενέργειες εμφανίστηκαν με συχνότητα κάτω του 2%.1 Ένας ασθενής που εμφάνισε ανεπιθύμητες ενέργειες βαριάς μορφής (αποφρακτική δυσκοιλιότητα, τρόμο, αίσθημα παλμών) αποχώρησε από τη μελέτη.
Υπάρχουν περιορισμοί σε σχέση με αυτή την ανάλυση, οι οποίοι θα πρέπει να σημειωθούν. Τα δεδομένα αυτά παρατηρήθηκαν σε μία ενδιάμεση ανάλυση της μελέτης. Επιπρόσθετα ευρήματα από τη μελέτη θα είναι διαθέσιμα με την ολοκλήρωση της μελέτης και αναμένονται τους προσεχείς μήνες. Το κύριο καταληκτικό σημείο ορίστηκε ως το ποσοστό των ασθενών με βελτίωση της βαθμολογίας στο Δερματολογικό Δείκτη Ποιότητας Ζωής (DLQI) κατά τουλάχιστον πέντε μονάδες σε σύγκριση με την έναρξη της μελέτης ή με βαθμολογία ≤ 5 μετά από τέσσερις μήνες. Ωστόσο, μία τέτοια βελτίωση είναι δύσκολο να αξιολογηθεί σε ασθενείς με ποιότητα ζωής που δεν έχει επηρεαστεί σημαντικά κατά την έναρξη της μελέτης, όπως ίσχυε στις περιπτώσεις κάποιων από τους ασθενείς που ξεκίνησαν με βαθμολογία ≤ 5 στον DLQI. Για τον λόγο αυτόν, 73 ασθενείς της αρχικής ομάδας της μελέτης συμπεριλήφθηκαν στον πληθυσμό ανάλυσης. Αν και αυτά τα ενδιάμεσα δεδομένα κατέδειξαν μία μείωση στη βαρύτητα της προσβολής των ονύχων, του τριχωτού της κεφαλής και των παλαμών-πελμάτων, θα πρέπει να σημειωθεί ότι ένας μικρός μόνο αριθμός ασθενών στον πληθυσμό της μελέτης παρουσίασε τέτοιες εκδηλώσεις της νόσου.
Σχετικά με την απρεμιλάστη
Η απρεμιλάστη είναι ένας από του στόματος μικρομοριακός αναστολέας της φωσφοδιεστεράσης 4 (PDE4), ενός ενζύμου ειδικού για την κυκλική μονοφωσφορική αδενοσίνη (cAMP). Η αναστολή της PDE4 έχει ως αποτέλεσμα την αύξηση των επιπέδων της ενδοκυτταρικής cAMP, η οποία πιστεύεται ότι ρυθμίζει εμμέσως την παραγωγή φλεγμονωδών μεσολαβητών.
Θεραπευτικές ενδείξεις
Η απρεμιλάστη είναι εγκεκριμένη για τη θεραπεία της μέτριας έως σοβαρής χρόνιας κατά πλάκας ψωρίασης σε ενήλικες ασθενείς οι οποίοι δεν ανταποκρίθηκαν, ή έχουν κάποια αντένδειξη, ή εμφάνισαν μη ανοχή σε άλλη συστημική θεραπεία, συμπεριλαμβανομένης της κυκλοσπορίνης, της μεθοτρεξάτης ή του ψωραλενίου και της υπεριώδους ακτινοβολίας Α (PUVA). Η απρεμιλάστη, ως μονοθεραπεία ή σε συνδυασμό με Τροποποιητικά της Νόσου Αντιρρευματικά Φάρμακα (DMARDs), ενδείκνυται επίσης για τη θεραπεία της ενεργού ψωριασικής αρθρίτιδας σε ενήλικες ασθενείς οι οποίοι είχαν ανεπαρκή ανταπόκριση ή εμφάνισαν μη ανοχή σε προηγούμενη θεραπεία με DMARD.
Αντενδείξεις
Η απρεμιλάστη αντενδείκνυται σε ασθενείς με υπερευαισθησία στη δραστική ουσία ή σε κάποιο από τα έκδοχα αυτού του σκευάσματος. Η απρεμιλάστη αντενδείκνυται κατά τη διάρκεια της κύησης.
Προειδοποιήσεις και προφυλάξεις
Οι ασθενείς με σπάνια κληρονομικά προβλήματα δυσανεξίας στη γαλακτόζη, έλλειψη λακτάσης Lapp ή κακή απορρόφηση γλυκόζης-γαλακτόζης δεν πρέπει να λαμβάνουν αυτό το φάρμακο. Η ασφάλεια της απρεμιλάστης δεν αξιολογήθηκε σε ασθενείς με ψωριασική αρθρίτιδα ή με ψωρίαση και με μέτρια ή σοβαρή νεφρική δυσλειτουργία στις κλινικές μελέτες. Η δόση της απρεμιλάστης θα πρέπει να μειώνεται στα 30 mg άπαξ ημερησίως σε ασθενείς με σοβαρή νεφρική δυσλειτουργία.
Μείωση σωματικού βάρους: Η μέση παρατηρούμενη απώλεια βάρους σε ασθενείς που υπεβλήθησαν σε θεραπεία για έως και 52 εβδομάδες με απρεμιλάστη ήταν 1,99 kg. Συνολικά, στο 14,3% των ασθενών που λάμβαναν απρεμιλάστη είχε παρατηρηθεί απώλεια σωματικού βάρους μεταξύ 5-10%, ενώ στο 5,7% των ασθενών που λάμβαναν απρεμιλάστη είχε παρατηρηθεί απώλεια βάρους μεγαλύτερη από 10%. Κανένας από αυτούς τους ασθενείς δεν είχε εμφανείς κλινικές συνέπειες προκύπτουσες από την απώλεια βάρους. Συνολικά, το 0,1% των ασθενών που λάμβαναν θεραπεία με απρεμιλάστη διέκοψαν τη θεραπεία, λόγω της ανεπιθύμητης ενέργειας της απώλειας βάρους. Θα πρέπει να παρακολουθείται τακτικά το σωματικό βάρος ασθενών που είναι λιποβαρείς κατά την έναρξη της θεραπείας. Σε περίπτωση ανεξήγητης και κλινικά σημαντικής απώλειας σωματικού βάρους, αυτοί οι ασθενείς θα πρέπει να αξιολογούνται από έναν γιατρό και να εξετάζεται το ενδεχόμενο διακοπής της θεραπείας.
Εγκυμοσύνη: Η περίπτωση εγκυμοσύνης θα πρέπει να αποκλείεται πριν την έναρξη της θεραπείας. Οι γυναίκες σε αναπαραγωγική ηλικία θα πρέπει να χρησιμοποιούν αποτελεσματική αντισύλληψη για την πρόληψη εγκυμοσύνης κατά τη διάρκεια της θεραπείας.
Περίληψη του προφίλ ασφάλειας
Οι πιο συχνά αναφερόμενες ανεπιθύμητες ενέργειες σε κλινικές μελέτες Φάσης ΙΙΙ αφορούσαν διαταραχές του γαστρεντερικού, συμπεριλαμβανομένης της διάρροιας (15,7%) και της ναυτίας (13,9%). Αυτές οι ανεπιθύμητες ενέργειες του γαστρεντερικού ήταν κυρίως ήπιας έως μέτριας σοβαρότητας, με το 0,3% της διάρροιας και το 0,3% της ναυτίας να αναφέρονται ως σοβαρές. Αυτές οι ανεπιθύμητες ενέργειες εκδηλώθηκαν γενικώς εντός των πρώτων 2 εβδομάδων θεραπείας και συνήθως υποχωρούσαν εντός 4 εβδομάδων. Στις άλλες πιο συχνά αναφερόμενες ανεπιθύμητες ενέργειες συμπεριλαμβάνονταν λοιμώξεις του ανώτερου αναπνευστικού συστήματος (8,4%), κεφαλαλγία (7,9%) και κεφαλαλγία τάσεως (7,2%). Συνολικά, οι περισσότερες ανεπιθύμητες ενέργειες θεωρήθηκαν ήπιας ή μέτριας σοβαρότητας.
Οι πιο συχνές ανεπιθύμητες ενέργειες που οδήγησαν στη διακοπή της θεραπείας κατά τη διάρκεια των πρώτων 16 εβδομάδων ήταν η διάρροια (1,7%) και η ναυτία (1,5%). Η συνολική συχνότητα εμφάνισης σοβαρών ανεπιθύμητων ενεργειών ήταν χαμηλή και δεν υπέδειξε τη συμμετοχή οποιουδήποτε ειδικού οργανικού συστήματος. Παρατηρήθηκαν αντιδράσεις υπερευαισθησίας όχι συχνά σε κλινικές μελέτες της απρεμιλάστης.
Σε κλινικές μελέτες και κατά την εμπειρία μετά την κυκλοφορία στην αγορά, αναφέρθηκαν όχι συχνά περιστατικά αυτοκτονικού ιδεασμού και αυτοκτονικής συμπεριφοράς, ενώ η αυτοκτονία αναφέρθηκε κατά την εμπειρία μετά την κυκλοφορία στην αγορά.
Ειδικοί πληθυσμοί
Δεν παρατηρήθηκε συνολική διαφορά στο προφίλ ασφάλειας των ηλικιωμένων ασθενών ηλικίας ≥ 65 ετών και των νεότερων ενηλίκων ασθενών ηλικίας < 65 ετών στις κλινικές μελέτες. Η ασφάλεια της απρεμιλάστης δεν αξιολογήθηκε σε ασθενείς με ψωριασική αρθρίτιδα ή ψωρίαση και με ηπατική δυσλειτουργία. Η ασφάλεια και η αποτελεσματικότητα της απρεμιλάστης σε παιδιά ηλικίας 0 έως 17 ετών δεν έχουν τεκμηριωθεί και δεν υπάρχουν διαθέσιμα δεδομένα.
Σχετικά με την ψωρίαση
Η ψωρίαση προσβάλλει περίπου 14 εκατομμύρια ανθρώπους στην Ευρώπη. Είναι μία χρόνια και συστηματική φλεγμονώδης διαταραχή του δέρματος και είναι ανοσομεσολαβούμενη, το οποίο σημαίνει ότι προκαλείται από μία ανοσολογική αντίδραση στον οργανισμό. Οι βλάβες της ψωρίασης μπορούν συχνά να ανιχνευθούν σε περιοχές κοντά στις αρθρώσεις, όπως οι αγκώνες και τα γόνατα, αλλά μπορούν επίσης να εμφανιστούν και στο τριχωτό της κεφαλής. Η ψωρίαση των ονύχων προσβάλλει έως και το 50% των ατόμων με ψωρίαση και έως και το 90% των ατόμων που πάσχουν από ψωριασική αρθρίτιδα. Έως και το 84% των ατόμων με ψωρίαση παρουσιάζει κνησμό, ενώ περισσότεροι από το ένα τρίτο των ασθενών πρακτικά αναφέρουν τον κνησμό ως τον πλέον σημαντικό επιβαρυντικό παράγοντα της νόσου τους.
Σχετικά με τη Celgene
Η Celgene International Sàrl, με έδρα στο Boudry της Ελβετίας, είναι θυγατρική και η Διεθνής Έδρα της Celgene Corporation. Η Celgene Corporation, με έδρα στο Summit του New Jersey, είναι μία διεθνής φαρμακευτική εταιρεία που δραστηριοποιείται κατά κύριο λόγο στην ανακάλυψη, ανάπτυξη και προώθηση καινοτόμων θεραπειών για την αντιμετώπιση του καρκίνου και των φλεγμονωδών νοσημάτων μέσω της γονιδιακής και πρωτεϊνικής ρύθμισης.
Για περισσότερες πληροφορίες, παρακαλούμε επισκεφθείτε το website της εταιρείας www.celgene.com. Ακολουθήστε τη Celgene στα social media: @Celgene, Pinterest, LinkedIn, FaceBook και YouTube.
Εκτιμήσεις της Celgene για μελλοντικά γεγονότα
Αυτό το Δελτίο Τύπου περιέχει δηλώσεις πρόβλεψης, οι οποίες αποτελούν γενικές δηλώσεις και όχι ιστορικά δεδομένα. Τέτοιες δηλώσεις μπορεί να προσδιορίζονται με τις λέξεις «αναμένει», «προσδοκά», «πιστεύει», «σκοπεύει», «εκτιμά», «σχεδιάζει», «θα», «προοπτική» και παρόμοιες εκφράσεις. Οι δηλώσεις πρόβλεψης βασίζονται στα τρέχοντα σχέδια, τους υπολογισμούς, τις παραδοχές και τις εκτιμήσεις της Διοίκησης, και αναφέρονται μόνο στην ημερομηνία που πραγματοποιούνται. Δεν αναλαμβάνουμε καμία υποχρέωση να επικαιροποιήσουμε οποιαδήποτε από αυτές τις δηλώσεις εφόσον προκύψουν νέες πληροφορίες ή μελλοντικά γεγονότα, εκτός εάν απαιτείται από το νόμο. Οι δηλώσεις πρόβλεψης εμπεριέχουν εγγενείς κινδύνους και αβεβαιότητες, που κατά πλειοψηφία είναι δύσκολο να προβλεφθούν και γενικά είναι πέρα από τον έλεγχό μας.
Τα πραγματικά αποτελέσματα ή εκβάσεις μπορεί να διαφέρουν ουσιωδώς από εκείνες που συνάγονται από τις δηλώσεις πρόβλεψης, ως αποτέλεσμα της επίδρασης μιας σειράς παραγόντων, πολλοί από τους οποίους περιλαμβάνονται με περισσότερες λεπτομέρειες στην Ετήσια Έκθεσή μας στο Form 10-K και σε άλλες εκθέσεις που κατατίθενται στην Επιτροπή Κεφαλαιαγοράς.
Σχετικά με τη GENESIS Pharma
Η GENESIS Pharma υπήρξε μια από τις πρώτες φαρμακευτικές εταιρείες σε ευρωπαϊκό επίπεδο με εξειδίκευση σε προϊόντα φαρμακευτικής βιοτεχνολογίας και είναι σήμερα η μεγαλύτερη μεταξύ των ελληνικών εταιρειών που εξειδικεύονται σε πρωτότυπα και καινοτόμα φάρμακα. Διαθέτει ένα εκτεταμένο χαρτοφυλάκιο προϊόντων υψηλής τεχνολογίας για σοβαρές και σπάνιες παθήσεις, λειτουργώντας ως εμπορικός συνεργάτης κορυφαίων πολυεθνικών φαρμακευτικών εταιρειών έρευνας και ανάπτυξης για την ευρύτερη περιοχή της ΝΑ Ευρώπης.
Η GENESIS Pharma δραστηριοποιείται σε διάφορους θεραπευτικούς τομείς. Διαθέτει σημαντικό εύρος καινοτόμων θεραπειών για σπάνιες αιματολογικές κακοήθειες και απειλητικές μορφές καρκίνου, όπως το πολλαπλό μυέλωμα, μορφές λευχαιμίας, ο μεταστατικός καρκίνος του παγκρέατος, ο μεταστατικός καρκίνος του μαστού κ.α. Μπορεί, επίσης, να χαρακτηριστεί ως μια από τις πλέον εξειδικευμένες εταιρείες στην Ελλάδα στον τομέα της πολλαπλής σκλήρυνσης. Παράλληλα, δραστηριοποιείται στους τομείς της δερματολογίας, ρευματολογίας και της νεφρολογίας. Για περισσότερες πληροφορίες, παρακαλούμε επισκεφθείτε το website της εταιρείας www.genesispharma.com.
ΠΗΓΗ: iatropedia.gr
